| Альфа-амилаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
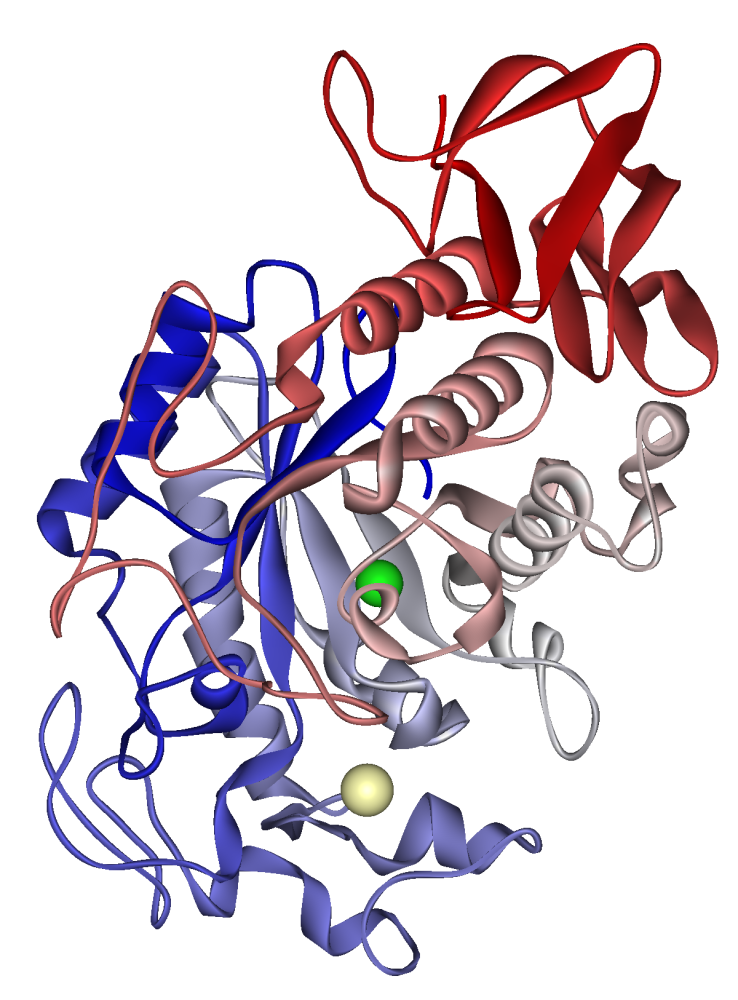
Адамның сілекейлі амилазасы: бозғылт хакиде кальций ионы, жасыл түсте хлорид ионы. PDB 1SMD
|
|||||||||
| Идентификаторлар | |||||||||
| EC жоқ. | 3.2.1.0 | ||||||||
| CAS жоқ. | 9000-90-2 | ||||||||
| Мәліметтер базасы | |||||||||
| IntEnz | IntEnz көрінісі | ||||||||
| БРЕНДА | BRENDA жазбасы | ||||||||
| ExPASy | NiceZyme көрінісі | ||||||||
| KEGG | KEGG кірісі | ||||||||
| MetaCyc | метаболизм жолы | ||||||||
| PRIAM | профиль | ||||||||
| PDB құрылымдары | RCSB PDB PDBe PDBsum | ||||||||
|
|||||||||
| GH13 каталитикалық домен | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Циклодекстрин глюканотрансфераза (ec2.4.1.19) (cgtase)
|
|||||||||
| Идентификаторлар | |||||||||
| Таңба | Альфа-амилаза | ||||||||
| Pfam | PF00128 | ||||||||
| Pfam руы | CL0058 | ||||||||
| InterPro | IPR006047 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
| OPM суперотбасы | 117 | ||||||||
| OPM ақуызы | 1wza | ||||||||
| CAZy | GH13 | ||||||||
| CDD | CD11338 | ||||||||
|
|||||||||
| Альфа-амилаза С-терминалының бета-парағының домені | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Арпаның альфа-амилаза изозимасы 1 (ами1) белсенді емес мутант d180a-ның мальтогептаозбен кешеніндегі кристалдық құрылымы
|
|||||||||
| Идентификаторлар | |||||||||
| Таңба | Альфа-амил_С2 | ||||||||
| Pfam | PF07821 | ||||||||
| InterPro | IPR012850 | ||||||||
|
|||||||||
| Альфа-амилаза, С-терминалдың барлық бета-домені | |||||||||
|---|---|---|---|---|---|---|---|---|---|
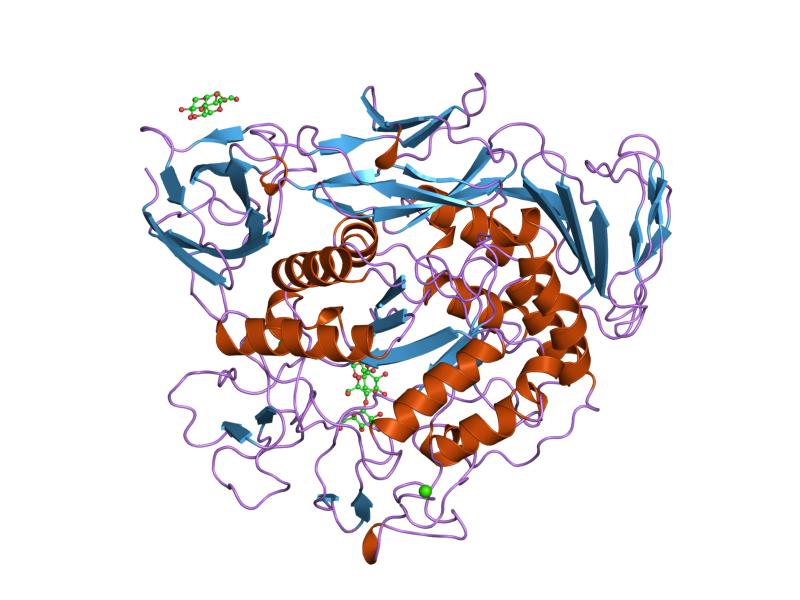
алдын-ала шартталған циклодекстрин гликозилтрансфераза мутантының малтотриоздық кешені
|
|||||||||
| Идентификаторлар | |||||||||
| Таңба | Альфа-амилаза_С | ||||||||
| Pfam | PF02806 | ||||||||
| Pfam руы | CL0369 | ||||||||
| InterPro | IPR006048 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
|
|||||||||
Альфа-амилаза, (α-амилаза) крахмал және гликоген тәрізді ірі, альфа-байланысқан полисахаридтердің альфа байланыстарын гидролиздейтін, одан қысқа тізбектер, декстриндер және мальтозалар шығаратын EC 3.2.1 ферменті болып табылады. Бұл адамдарда және басқа сүтқоректілерде кездесетін амилазаның негізгі түрі. Сондай-ақ, ол құрамында қоры бар крахмал бар тұқымдарда болады және оны көптеген саңырауқұлақтар бөледі. Бұл гликозидті гидролаза отбасының мүшесі 13.
Адам биологиясында
Көптеген тіндерде кездессе де, амилаза ұйқы безі сөлінде және сілекейде ерекше көзге түседі, олардың әрқайсысында адамның α-амилазасының өзіндік изоформасы болады. Олар изоэлектрлік фокуста әр түрлі әрекет етеді, сонымен қатар белгілі бір моноклоналды антиденелерді қолдану арқылы тестілеу кезінде оларды бөлуге болады. Адамдарда барлық амилаза изоформалары 1p21 хромосомасымен байланысады (AMY1A қараңыз).
Сілекей амилазасы (птиалин)
Амилаза сілекейде болады және крахмалды мальтоза мен декстринге бөледі. Амилазаның бұл формасы «птиалин» деп те аталады /ˈтaɪәлɪn/, оны швед химигі Йонс Якоб Берцелиус атады. Бұл атау гректің πτυω (түкіремін) сөзінен шыққан, себебі зат сілекейден алынған. Ол ірі, ерімейтін крахмал молекулаларын еритін крахмалдарға (амилодекстрин, эритродекстрин және ахродекстрин) бөліп, біртіндеп кішірек крахмалдар шығарады және ақырында мальтозаны құрайды. Птиалин сызықтық α (1,4) гликозидтік байланыстарға әсер етеді, бірақ қосылыс гидролизі үшін тармақталған өнімдерге әсер ететін фермент қажет. Сілекей амилазы асқазанда асқазан қышқылымен инактивтеледі. РН 3.3 деңгейіне келтірілген асқазан сөлінде птиалин 37 минутта 20 минут ішінде мүлдем инактивтелген. Керісінше, амилазаның 50% белсенділігі рН 4.3 кезінде асқазан сөлінің әсерінен 150 минут өткеннен кейін қалды. Екі крахмал, птиалинге арналған субстрат және өнім (глюкозаның қысқа тізбектері) оны асқазан қышқылымен инактивациядан ішінара қорғауға қабілетті. РН 3.0 кезінде буферге қосылған птялин 120 минут ішінде толық инактивациядан өтті; алайда, 0,1% деңгейінде крахмал қосқанда белсенділіктің 10% -ы қалды, ал 1,0% деңгейінде крахмалды қосқанда белсенділіктің шамамен 40% -ы 120 минутта қалды.
Птиалин үшін оңтайлы жағдайлар
- Оңтайлы рН – 7,0
- Адам денесінің температурасы
- Белгілі бір аниондар мен активаторлардың болуы:
- Хлорид пен бромид – ең тиімді
- Йодид – тиімділігі төмен
- Сульфат және фосфат – тиімділігі аз
Адамның сілекейлі амилазасының генетикалық өзгеруі
Эволюция кезінде сілекейлі амилаза генінің қайталануы болды, ал ДНҚ-ны будандастыру зерттеулері көптеген адамдарда геннің бірнеше рет тандемдік қайталануы болғанын көрсетеді. Гендердің көшірмелерінің саны сілекейлі амилаза деңгейімен корреляцияланады, өйткені адам амилазасына антиденелерді қолдана отырып белокты блот талдауымен өлшенеді. Гендердің көшірмесі жоғары крахмал диеталарының эволюциялық әсерімен байланысты. Мысалы, жапондық адамда амилаза генінің 14 данасы болған (бір аллель 10 данадан, ал екінші аллель төрт данадан тұрады). Жапон диетасында дәстүрлі түрде күріш крахмалы көп мөлшерде болған. Керісінше, Биака адамы алты данадан (әр аллелде үш данадан) алып жүрді. Биака – дәстүрлі түрде крахмалы төмен диетаны қолданған тропикалық ормандарды жинайтын аңшылар. Перри және оның әріптестері сілекейлі амилаза генінің көшірме санының көбеюі адамның эволюциясы кезінде крахмалды диетаға ауысқан кезде тіршілік етуді күшейтуі мүмкін деп болжады.
Ұйқы безінің амилазы
Ұйқы безі α-амилаза декрин, мальтоза немесе мальтотриоз алу үшін амилозаның α (1-4) гликозидтік байланысын кездейсоқ түрде үзіп тастайды. Ол аномериялық конфигурацияны сақтай отырып, екі рет орын ауыстыру механизмін қолданады. Адамдарда сілекей амилазасы оның көшірмесінен дамыды.
Патологияда
Липазаға қарағанда амилазаға тест оңайырақ болады, бұл панкреатитті анықтау және бақылау үшін қолданылатын алғашқы сынақ. Медициналық зертханалар әдетте ұйқы безі амилазасын немесе жалпы амилазаны өлшейді. Егер тек панкреатиялық амилаза өлшенсе, паротитпен немесе сілекей безінің басқа жарақаттарымен ұлғаю байқалмайды.
Алайда, аз мөлшерде болғандықтан, қан өлшеу үшін уақыт өте маңызды. Панкреатитпен ауырғаннан кейін көп ұзамай қан алу керек, әйтпесе ол бүйрек арқылы тез шығарылады.
Сілекейлі а-амилаза стресс кезінде биомаркер ретінде және қан алуды қажет етпейтін симпатикалық жүйке жүйесінің (SNS) қызметінің суррогаты ретінде пайдаланылды.
Түсіндіру
Адамдардағы плазма деңгейінің жоғарылауы келесіде кездеседі:
- Сілекей жарақаты (анестезиялық интубацияны қосқанда)
- Паротит – сілекей бездерінің қабынуына байланысты
- Панкреатит – амилаза түзетін жасушалардың зақымдануынан
- Бүйрек жеткіліксіздігі – шығарылуының төмендеуіне байланысты
Жалпы амилаза көрсеткіштері нормадан жоғары деңгейден 10 есе асып кетсе (ҰЖЖ) панкреатит туралы айтады. ЖЖЖ-ден 5-10 есеге дейін ішек немесе он екі елі ішектің ауруы немесе бүйрек жеткіліксіздігі болуы мүмкін, ал төменгі деңгейлер әдетте сілекей безі ауруында кездеседі.
Гендер
- сілекейлі – AMY1A, AMY1B, AMY1C
- ұйқы безі – AMY2A, AMY2B
Астықта
Дәндегі α-амилазаның белсенділігі, мысалы, Хагберг-Пертеннің құлау нөмірімен, өсімдіктің зақымдануын бағалауға арналған сынақпен немесе Phadebas әдісімен өлшенеді. Бидайда кездеседі.
Өнеркәсіптік пайдалану
α-амилаза этанол өндірісінде дәндердегі крахмалды ашытылатын қантқа бөлу үшін қолданылады.
Жоғары фруктозалы жүгері шәрбаты өндірісінің алғашқы қадамы олигосахаридтерден қысқа тізбектер шығаратын жүгері крахмалын α-амилазамен өңдеу болып табылады.
«Термамил» деп аталатын α-амилаза Bacillus licheniformis, кейбір жуу құралдарында, әсіресе ыдыс жуатын және крахмалды кетіретін жуу құралдарында қолданылады.
Жалпы амилазалар тобын көбірек пайдалану үшін амилазды қараңыз.
Медициналық қолдану мүмкіндігі
α-Амилаза жасушадан тыс полимерлі заттың (EPS) құрылымдық, матрицалық экзополисахаридтері ішіндегі α (1-4) гликозидтік байланыстарды гидролиздеу арқылы полимикробтық бактериалды биофильмдерді ыдыратуда тиімділік көрсетті.
Буферді тежеу
Трис молекуласы бірқатар бактериялық α-амилазаларды тежейтіні туралы хабарланған, сондықтан оларды трис буферінде қолдануға болмайды.
Анықтау
Α-амилазаның белсенділігін анықтауға арналған бірнеше әдістер бар, ал әр түрлі салалар әр түрлі әдістерге сүйенеді. Йод сынағының дамуы, крахмалды йод сынағы түс өзгеруіне негізделген, өйткені α-амилаза крахмалды ыдыратады және көптеген қолданбаларда қолданылады. Ұқсас, бірақ өндірістік жолмен өндірілген сынақ – бұл жуғыш заттар, түрлі ұн, дәнді дақылдар және уыт тағамдары, сот-биология сияқты көптеген салаларда сапалы және сандық сынақ ретінде қолданылатын Phadebas amylase сынағы.
Домендік архитектура
α-амилазалардың құрамында бірқатар белоктық домендер бар. Каталитикалық домен құрамында бета тізбегі 3 мен альфа спиралі 3 арасында шығып тұрған ~ 70-аминқышқылымен кальций байланыстыратын доменмен үзілген, белсенді учаскені қамтитын сегіз тізбекті альфа / бета баррельден тұратын құрылым және грек карбоксил-терминалы бар. бета-баррельдің негізгі домені. Бірнеше альфа-амилазалар бета-парақ доменін қамтиды, әдетте С терминалында. Бұл домен параллельге қарсы бес тізбекті бета-парақ ретінде ұйымдастырылған. Бірнеше альфа-амилазалардың құрамында бета-домен бар, әдетте С терминалында.
.














