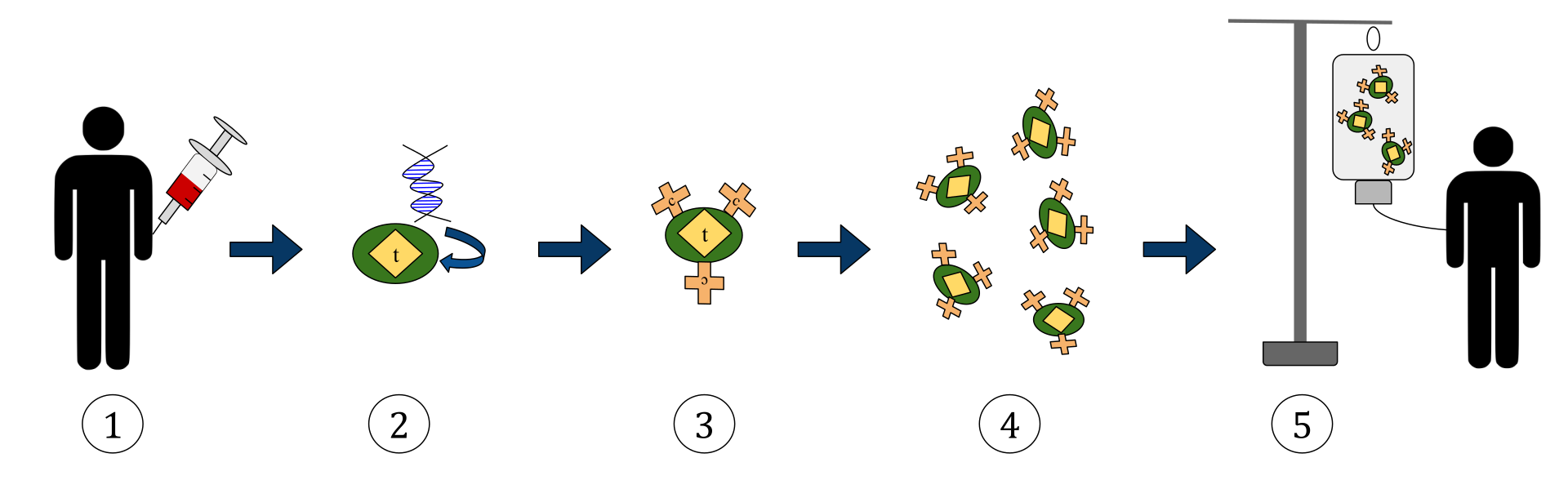
Жоғарыда келтірілген диаграмма химериялық антиген рецепторларының Т-жасушалық терапия процесін көрсетеді (CAR). Бұл қатерлі ісік ауруларын емдеуде өсіп келе жатқан тәжірибе болып табылатын иммунотерапия әдісі. Соңғы нәтиже денеде жұқтырылған қатерлі ісік жасушаларын танып, оларға қарсы тұра алатын жабдықталған Т-жасушалар өндірісі болуы керек.
1. Т-жасушалар («t» деп белгіленген заттармен ұсынылған) пациенттің қанынан алынады.
2. Содан кейін зертханалық жағдайда арнайы антиген рецепторларын кодтайтын ген Т-жасушаларына қосылады.
3. Осылайша, жасушалардың бетінде CAR рецепторларын шығарады (с деп белгіленеді).
4. Жаңа модификацияланған Т-жасушалар одан әрі жиналып, зертханада өсіріледі.
5. Белгілі бір уақыт өткеннен кейін, құрастырылған Т-жасушалар науқасқа қайтадан құйылады.
Химиялық антиген рецепторларының Т жасушалары (сонымен бірге CAR T жасушалары) иммунотерапияда қолдану үшін жасанды Т-жасуша рецепторын жасау үшін генетикалық түрде құрастырылған Т-жасушалар.
Химиялық антиген рецепторлары (Көліктер, сондай-ақ химиялық иммунорецепторлар, химиялық Т жасушаларының рецепторлары, немесе жасанды Т-жасушалық рецепторлар) – бұл Т-жасушаларына белгілі бір ақуызға бағытталған жаңа мүмкіндік беру үшін құрастырылған рецепторлық ақуыздар. Рецепторлар химерлі, өйткені олар антигенмен байланысатын және Т-жасушаны активтендіретін функцияларды бір рецепторға біріктіреді.
CAR-T клеткалық терапия CAR терапиясымен қатерлі ісік терапиясына арналған Т жасушаларын қолданады. CAR-T иммунотерапиясының алғышарты – Т жасушаларын рак клеткаларын тану үшін өзгерту және оларды тиімді түрде жою. Ғалымдар адамдардан Т жасушаларын жинайды, оларды генетикалық түрде өзгертеді, содан кейін пайда болған CAR-T жасушаларын пациенттерге олардың ісіктеріне шабуыл жасау үшін енгізеді. CAR-T жасушалары пациенттің өз қанындағы Т-жасушалардан (аутологиялық) немесе басқа сау донордың (аллогендік) Т-жасушаларынан алынуы мүмкін. Адамнан оқшауланғаннан кейін, бұл Т-жасушалар генетикалық түрде белгілі бір CAR экспрессиясын жасайды, ол оларды ісіктердің бетінде болатын антигенге бағыттауға бағыттайды. Қауіпсіздік үшін CAR-T жасушалары сау жасушаларда көрсетілмеген ісікке антигенге тән болуы керек.
CAR-T жасушалары науқасқа құйылғаннан кейін, олар рак клеткаларына қарсы «тірі препарат» ретінде әрекет етеді. Олар жасушадағы мақсатты антигенмен байланысқа түскенде, CAR-T жасушалары оған қосылып, активтенеді, содан кейін көбейіп, цитотоксикалық күйге көшеді. CAR-T жасушалары бірнеше тетіктер арқылы жасушаларды бұзады, соның ішінде клеткалардың кеңейтілген пролиферациясы, олардың басқа тірі жасушаларға уыттылық дәрежесін жоғарылатады (цитотоксичность) және цитокиндер, интерлейкиндер және басқа жасушаларға әсер етуі мүмкін факторлардың секрециясы жоғарылайды. өсу факторлары.
CAR-T жасушаларының өндірісі

CAR-T жасушаларының өндірісіндегі алғашқы қадам – бұл Т-жасушаларын адам қанынан бөліп алу. CAR-T жасушаларын пациенттің аутологиялық емдеу деп аталатын қанынан немесе аллогендік емдеу деп аталатын сау донордың қанынан өндіруге болады. Екі жағдайда да өндіріс процесі бірдей; тек бастапқы қан донорының таңдауы әртүрлі.
Біріншіден, лейкоциттер лейкоциттер аферезасы деп аталатын процесте қан жасушаларының сепараторын қолдану арқылы оқшауланады. Содан кейін перифериялық қанның бір ядролы жасушалары (PBMC) бөлініп, жиналады. Содан кейін лейкоциттер аферезінің өнімдері жасушаларды өңдеу орталығына жіберіледі. Клеткаларды өңдеу орталығында спецификалық Т-клеткалар ынталандырылады, сондықтан олар белсенді көбейіп, көп мөлшерге дейін кеңейеді. Олардың кеңеюін қамтамасыз ету үшін T жасушаларын әдетте цитокин интерлейкин 2 (IL-2) және анти-CD3 антиденелерімен өңдейді.
Кеңейтілген Т-жасушалар тазартылады, содан кейін ретро-вирустық вектор арқылы, әдетте интеграцияланатын гамаретровирус (RV) немесе lentiviral (LV) векторы арқылы, құрастырылған CAR-ны кодтайтын генмен беріледі. Бұл векторлар U3 аймағын ішінара жоюдың арқасында қазіргі уақытта өте қауіпсіз. Жақында CAR генін геномдағы белгілі орындарға интеграциялау үшін ретровирустық векторлардың орнына гендерді түзетудің жаңа CRISPR / Cas9 құралы қолданылды.
Науқас инженерлік CAR-T жасушаларын енгізгенге дейін лимфодеплеция химиотерапиясынан өтеді. Науқаста айналымдағы лейкоциттер санының азаюы өндірілетін цитокиндердің санын қалыпқа келтіреді және ресурстарға бәсекелестікті азайтады, бұл CAR-T инженерлік жасушаларының кеңеюіне ықпал етеді.
Клиникалық қосымшалар
2019 жылдың наурызындағы жағдай бойынша бүкіл әлемде CAR-T жасушаларын қамтитын 364 клиникалық сынақтар болды. Осы сынақтардың көпшілігі қан қатерлі ісіктеріне бағытталған: CAR-T терапиясы гематологиялық қатерлі ісіктерге арналған сынақтардың жартысынан көбін құрайды. CD19 антигендердің ең танымал нысаны болып қала береді, содан кейін BCMA (көбінесе миеломада көрінеді). 2016 жылы зерттеулер CD20 сияқты басқа антигендердің өміршеңдігін зерттей бастады. Қатты ісіктерге арналған сынақтарда CAR-T аз басым болады, клеткалық терапияға негізделген сынақтардың жартысына жуығы NK жасушалары сияқты басқа платформаларды қамтиды.
Қатерлі ісік
Т-жасушалар генетикалық тұрғыдан науқастың ісік жасушаларында антигендерге бағытталған химерлі антиген рецепторларын экспрессиялау үшін жасалады, содан кейін науқасқа рак клеткаларын шабуылдап өлтіреді. CAR модификацияланған Т-жасушаларын іс жүзінде кез-келген ісікпен байланысты антигенге бағыттау үшін жасауға болады.
CAR-T жасушаларының алғашқы зерттеулері қан қатерлі ісіктеріне бағытталған. Алғашқы мақұлданған емдеу әдістерінде жедел лимфобластикалық лейкемия (ALL) және диффузды ірі В-жасушалы лимфома (DLBCL) сияқты В-жасушадан алынған қатерлі ісіктерде кездесетін CD19 антигеніне бағытталған CAR қолданылады. Сондай-ақ, басқа да көптеген қатерлі ісік антигендеріне, соның ішінде отқа төзімді Ходжкин лимфомасындағы CD30-ға бағытталған автомобильдерді жасау бойынша жұмыстар жүргізілуде; Жедел миелоидты лейкоздағы (AML) CD33, CD123 және FLT3; және BCMA көптеген миеломада.
Қатты ісіктер неғұрлым қиын мақсатты ұсынды. Жақсы антигендерді анықтау қиынға соқты: мұндай антигендер қатерлі ісік жасушаларының көпшілігінде жоғары дәрежеде болуы керек, бірақ көбінесе қалыпты тіндерде болмайды. CAR-T жасушалары қатты ісік массаларының ортасына тиімді түрде өткізілмейді, ал дұшпан ісік микроорганизмі Т жасушаларының белсенділігін басады.
Аутоиммунды ауру
CAR T-жасушаларының көптеген зерттеулері белгілі бір жасуша популяциясын жоюға болатын CAR T-жасушасын құруға бағытталған болса (мысалы, лимфома жасушаларына бағытталған CAR-жасушалары), бұл технологияны қолданудың басқа да мүмкіндіктері бар. Т-жасушалар өзіндік антигендерді аутоиммунды реакциялардан да қорғай алады. Автокөлікпен жабдықталған реттеуші Т-жасуша белгілі бір антигенге төзімділікке ие болуы мүмкін, бұл органды трансплантациялауда немесе лупус сияқты ревматикалық ауруларда қолданыла алады.
Сәтфи
Цитокинді босату синдромы мен неврологиялық уыттылықты қоса алғанда, организмге CAR-T жасушаларының енгізілуінен болатын жанама әсерлер бар. Бұл салыстырмалы түрде жаңа ем болғандықтан, CAR-T жасушалық терапиясының ұзақ мерзімді әсерлері туралы мәліметтер аз. Пациенттің ұзақ өмір сүруіне, сондай-ақ CAR-T жасушаларымен емделген әйел науқастарда жүктіліктің асқынуына қатысты алаңдаушылық бар. Анафилаксия күтілетін жанама әсері болып табылады, өйткені ОВА шетелдік моноклоналды антиденемен жасалады және нәтижесінде иммундық жауап тудырады.
Мақсатты / ісіктен тыс тану CAR-T жасушасы дұрыс антигенді анықтаған кезде пайда болады, бірақ антиген сау, патогенді емес тіндерде көрінеді. Нәтижесінде CAR-T жасушалары ісік емес тіндерге шабуыл жасайды, мысалы, CD19 экспрессиялайтын сау В клеткалары. Бұл жағымсыз әсердің ауырлығы әр түрлі болуы мүмкін, ол инфузиямен емделетін В-жасушалық аплазиядан, өлімге әкелетін улылыққа дейін.
Сондай-ақ, CAR-T жасушаларының инерциялық мутагенез жолымен қатерлі ісік жасушаларына айналуының ықтималдығы жоқ, себебі вирустық вектор CAR жүйесінің генін ісік супрессорына немесе иесі Т жасушасының геномына онкоген енгізеді. Кейбір ретровирустық (RV) векторлар лентивирустық (LV) векторларға қарағанда төмен қауіптілікке ие. Алайда, екеуінің де онкогенді болу мүмкіндігі бар. CAR жасушаларының функциясын және in vivo-да табандылықты жақсы түсіну үшін Т-жасушалардағы CAR-ді орналастыру орындарының геномдық реттілігін талдау жасалды.
Цитокинді босату синдромы
CAR-T жасушаларымен емдеуден кейінгі ең көп таралған мәселе – бұл цитокинді босату синдромы (CRS), иммундық жүйе белсеніп, қабынған цитокиндердің санын көбейтеді. Бұл синдромның клиникалық көрінісі жоғары температура, тез шаршағыштық, миалгия, жүрек айну, капиллярлардың ағуы, тахикардия және басқа жүрек қызметінің бұзылуы, бауыр жеткіліксіздігі, бүйрек функциясының бұзылуымен жүретін сепсиске ұқсайды. CRS CAR-T жасушалық терапиямен емделген барлық дерлік науқастарда кездеседі; шын мәнінде, CRS болуы диагностикалық маркер болып табылады, бұл CAR-T жасушаларының қатерлі ісік жасушаларын жоюға арналған жұмыс істейтіндігін көрсетеді. Алайда, CRS ауырлығының жоғарырақ дәрежесі емге жауаптың жоғарылауымен емес, аурудың ауырлығымен байланысты болатындығына назар аударыңыз.
Иммундық эффекторлы жасушамен байланысты нейроуыттылық
Неврологиялық уыттылық көбіне CAR-T жасушаларын емдеумен байланысты. Негізгі механизм нашар түсінілген және CRS-мен байланысты болуы мүмкін немесе болмауы мүмкін. Клиникалық көріністерге делирий, біртектес сөйлеу қабілетінің ішінара жоғалуы, тілді түсіндіру қабілетіне ие бола алады (экспрессивті афазия), байқалудың төмендеуі (обтундация) және ұстамалар. Кейбір клиникалық зерттеулер кезінде нейроуыттылықтан болатын өлім пайда болды. Нейроуыттылықтан болатын өлімнің негізгі себебі – церебральды ісіну. Juno Therapeutics, Inc компаниясы жүргізген зерттеуде сотқа тіркелген бес науқас церебральды ісіну салдарынан қайтыс болды. Науқастардың екеуі тек циклофосфамидпен емделді, ал қалған үшеуі циклофосфамид пен флударабиннің қосындысымен емделді. Фред Хатчинсон атындағы онкологиялық зерттеулер орталығы қаржыландырған тағы бір клиникалық сынақта CAR-T жасушаларын енгізгеннен кейін 122 күннен кейін қайтымсыз және өлімге әкелетін неврологиялық уыттылықтың бір жағдайы тіркелді.
.














